2021-08-17 13:33:26 来源:
评估LAVA-1207针对转移性去势抵抗性前列腺癌效果的1/2a期试验的CTA已被接受,IND得到许可;有望在今年晚些时候开始
与Janssen Biotech, Inc.的合作一直在顺利进行,并正在朝着预计的里程碑迈进
预计将为2023年下半年的业务提供1.51亿美元现金余额
荷兰乌得勒支和费城, Aug. 16, 2021 (GLOBE NEWSWIRE) -- 专注于开发双特异性γ-δ T细胞衔接抗体以改变癌症治疗的临床阶段生物技术公司LAVA Therapeutics N.V.(Nasdaq: LVTX)今天宣布了截止到2021年6月30日的第二季度业绩和公司最近的业务亮点。
LAVA Therapeutics首席执行官Stephen Hurly表示:“我们继续大力执行计划,实现了关键里程碑,并推进了两个领先的双特异性γ-δ T细胞衔接抗体临床项目。我们于本季度初启动了针对血液恶性肿瘤的LAVA-051试验,在这一良好势头的基础上,我们很高兴能在今年晚些时候对我们的第二个项目(针对转移性去势抵抗性前列腺癌的LAVA-1207试验)开始临床试验。展望今年下半年,我们不断扩大的领导能力、临床进展和强大的资产负债表为LAVA提供了实现企业价值的良好条件。我们的使命是打造变革性治疗方法,利用相关γ-δ T细胞的潜力,有效而精准地对抗癌症。”
最近的业务和渠道亮点
LAVA-051的1/2a期试验的第一例患者给药:7月,LAVA宣布已在公司的1/2a期临床试验中开始给药,评估LAVA-051对复发性和/或顽固性慢性淋巴细胞白血病(CLL)、多发性骨髓瘤(MM)和急性髓系白血病(AML)患者的治疗能力。LAVA-051是是一种人源化bsTCE,通过激活γ-δ T细胞和1型自然杀伤T(NKT)细胞,选择性地靶向表达CD1d的血液癌症。该试验旨在评估LAVA-051的安全性、耐受性、药代动力学、药效、免疫原性和初步抗肿瘤活性。1/2a期临床试验首先在欧洲进行,将在试验性新药(IND)申请被接受后扩展到美国。公司目前估计将在2022年上半年报告该研究的1期剂量递增阶段的数据,预计在2022年下半年获得2a期扩展队列的顶线临床数据。
LAVA-1207的CTA和IND已被接受:公司的CTA已被接受,IND已被批准,可以启动1/2a期临床研究,以评估LAVA-1207在转移性去势抵抗性前列腺癌患者中的耐受性和疗效。LAVA-1207是一款γ-δ bsTCE,靶向显示出临床前概念验证的前列腺特异性膜抗原(PSMA)。公司预计将在今年晚些时候在欧洲开始患者招募,之后不久将在美国开始患者招募。
与Janssen的研究和许可协议。根据协议条款,公司正在为治疗癌症,进行新的γ-δ T细胞双特异性抗体的研究和产品开发活动。这项合作正在顺利进行,除了预付款外,公司还有资格根据合作的推进,获得潜在的开发和商业里程碑以及未来的梯度许可费。
Amy Garabedian被任命为法律总监,增强了高管团队的实力:Amy Garabedian于2021年7月被任命为法律顾问和企业总法律顾问和企业秘书。Garabedian女士是一位备受赞誉的领导者,在生命科学行业拥有超过15年的企业和事务专业知识经验。Galabedian女士曾担任Spark Therapeutics(Roche)助理法律总监,帮助推动在美国成功启动利用基因疗法治疗基因疾病。她还领导关键业务开发交易,以实现临床前、临床和商业产品开发。
第二季度财务业绩
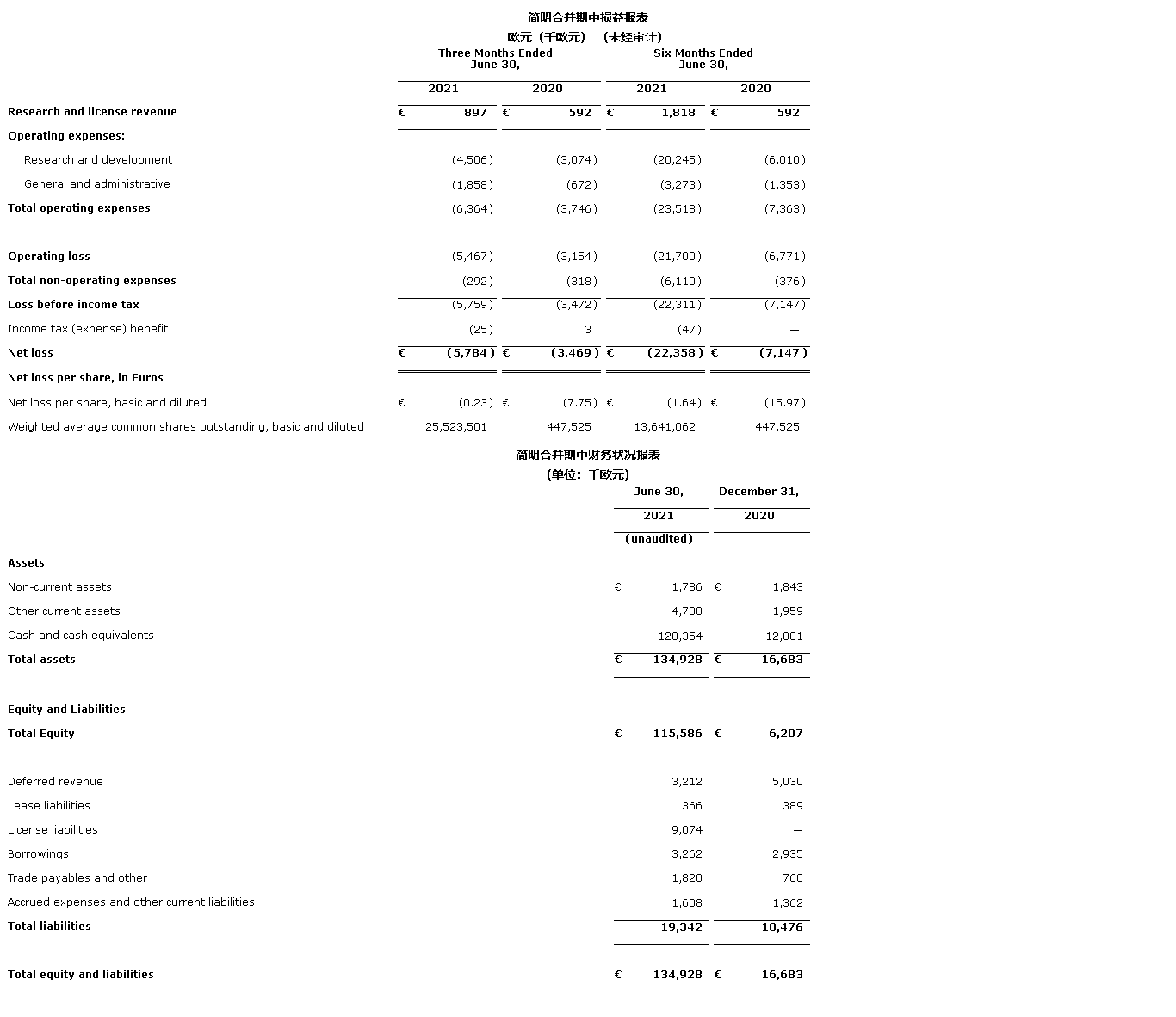
截至2021年6月30日,现金和现金等价物为1.284亿欧元,而截至2020年12月31日则为1290万欧元。现金和现金等价物的增加可归因于2021年第一季度期间来自C轮融资和随后的IPO收益,其中部分被运营费用抵消。
截至2021年6月30日,三个月和六个月的研究和许可收入分别增至90万欧元和180万欧元,而截至2020年6月30日的三个月和六个月中,该项收入为60万欧元。研究和许可收入完全归因于公司与Janssen Biotech, Inc.的合作,该公司于2020年5月与公司展开合作。
截至2021年6月30日,三个月和六个月的研究和开发费用分别增至450万欧元和2020万欧元,而截至2020年6月30日的三个月和六个月中,该项费用分别为310万欧元和600万欧元。截至2021年6月30日的三个月的费用增长,主要原因是我们开始LAVA-051临床试验而增加了人员数量和相关成本。截至2021年6月30日的六个月的费用增长,主要原因是IPO引起的1210万欧元许可费用,其中大部分将在IPO的第一和第二个周年日支付,可能以现金或公司普通股形式支付。
截至2021年6月30日的三个月和六个月的一般行政费用分别为190万欧元和330万欧元,而截至2020年6月30日的三个月和六个月的一般行政费用70万欧元和140万欧元。这两个时间段的费用增长主要是由于与人事有关的费用增加、基于非现金份额的补偿费用增加,以及与作为在美国上市的公司相关的额外费用增加。
截至2021年6月30日的三个月和六个月间,净亏损分别为580万欧元和2240万欧元,即每股亏损0.23欧元和1.64欧元,而截至2020年6月30日的三个月和六个月间,净亏损分别为350万欧元和710万欧元,即每股亏损7.75欧元和15.97欧元。
关于LAVA
LAVA Therapeutics N.V.是一家临床阶段生物技术公司,致力于开发双特异性γ-δ T细胞衔接抗体(γ-δ bsTCEs)系列药物,用于实体肿瘤和血液系统恶性肿瘤的治疗。公司的创新方法利用经专门设计的双特异性抗体,在交联到肿瘤相关抗原后,通过触发Vγ9Vδ2 T细胞抗肿瘤效应功能,选择性地杀死癌细胞。一项在某些血液系统恶性肿瘤患者中评估LAVA-051的1/2a期临床研究正在进行患者招募。公司目前估计将在2022年上半年获得该研究的1期剂量递增阶段的数据,预计在2022年下半年获得2a期扩展队列的顶线临床数据。公司计划于2021年下半年启动1/2a期临床研究,以在前列腺癌患者中对LAVA-1207进行评估。如需了解更多信息,请访问www.lavatherapeutics.com。
LAVA关于前瞻性陈述的警示说明
本新闻稿包含前瞻性陈述,其中包括临床试验时间安排等在内的公司预期增长和临床开发计划。诸如“预计”、“相信”、“可能”、“应该”、“计划”、“打算”、“预期”、“估计”、“潜力”等词语和类似表达(以及其他提及未来事件、条件或情况的其他词语或表达)旨在表示这些前瞻性陈述。这些前瞻性陈述均基于LAVA在截至本新闻稿发布之日的预期和假设。这些前瞻性陈述中的每一项均涉及风险和不确定性。实际结果与前瞻性陈述中的结果可能存在重大差异。本新闻稿中包含的前瞻性陈述包括但不限于关于以下事项的陈诉:临床试验进展、时间安排、临床开发和范围;有关LAVA候选药物的临床数据报告,以及我们候选药物用于治疗各种肿瘤靶点的潜在应用。许多因素可能导致当前预期与实际结果之间的差异,包括临床前试验期间观察到的意外的安全性或疗效数据;预期或现有竞争的变化;监管环境的变化;LAVA的合作方未能支持或推进协作或候选药物,以及意外诉讼或其他争议等。此外,新冠肺炎疫情可能破坏我们的业务以及我们所依赖的第三方业务,包括延迟或以其他方式干扰我们的临床试验和临床前研究、制造和供应链,或影响员工的工作效率。即使可获得新的信息,LAVA亦无责任对本文所载的任何前瞻性陈述进行更新以反映预期的任何变化。
投资者联系人:
Corey Davis博士
LifeSci Advisors
cdavis@lifesciadvisors.com
212-915-2577
免责声明:本网站(http://www.ciotimes.com/)内容主要来自原创、合作媒体供稿和第三方投稿,凡在本网站出现的信息,均仅供参考。本网站将尽力确保所提供信息的准确性及可靠性,但不保证有关资料的准确性及可靠性,读者在使用前请进一步核实,并对任何自主决定的行为负责。本网站对有关资料所引致的错误、不确或遗漏,概不负任何法律责任。
本网站刊载的所有内容(包括但不仅限文字、图片、LOGO、音频、视频、软件、程序等)版权归原作者所有。任何单位或个人认为本网站中的内容可能涉嫌侵犯其知识产权或存在不实内容时,请及时通知本站,予以删除。
